膠質母細胞瘤(glioblastoma,GBM)是星形細胞腫瘤中惡性程度最高的膠質瘤,具有高侵襲性、生長迅速、預后差等特點,是神經外科治療中最棘手的難治性腫瘤之一。臨床上將GBM分為三種亞型:促神經元亞型(proneural,PN),經典亞型(classical)和間充質亞型(mesenchymal,MES)[1-3]。一系列臨床數據證實,接受治療后的GBM存活細胞會從較低侵襲性的PN表型向更高侵襲性且產生治療抗性的MES表型轉化[2,4],從而增大了復發風險和后續治療難度。被寄予生存希望的臨床治療反而導致了腫瘤的進一步惡化,使得GBM的治療陷入了進退兩難的境地。
那到底是什么原因導致了這種現象的發生?腫瘤的惡化真的是由治療造成的嗎?背后的分子機制又是怎樣?來自伯明翰阿拉巴馬大學(UAB)的神經外科教授Nakano博士的研究也許可以為我們找到問題的答案。

2018年7月份,一篇來自美國、俄羅斯、韓國和中國的聯合研究小組-Nakano團隊的研究發現,發生凋亡的GBM細胞通過其誘導和釋放的細胞外囊泡(apoptotic extracellular vesicles,apoEVs)向鄰近的存活腫瘤細胞發送信號,從而促進后者的增殖、侵襲性、運動性以及對放射或化學療法的抗性。接著,研究者鑒定出一個代表性剪接因子—RBM11,該因子在腫瘤治療后出現表達上調,并且散布在細胞凋亡后分泌的細胞外囊泡中。這些囊泡一旦進入受體細胞,剪接因子RBM11將會改變細胞內MDM4和細胞周期蛋白D1的剪接方式,導致更具致癌性的細胞亞型發生表達。因此,該機制成為治療原發性腦癌膠質母細胞瘤的新療法的可能靶標,并且可適用于其他癌癥類型。
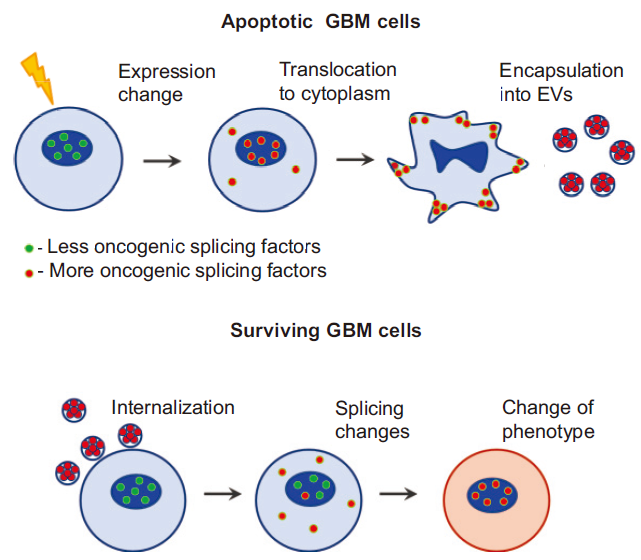
該文章以“Apoptotic Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors”為題發表于權威期刊Cancer Cell(IF22.8)[5],并在可變剪接的研究部分對烈冰自主研發的可變剪接算法ASD進行了引用。

文章思路:
(1)對apoEVs促進受體細胞的增殖、侵襲性和治療抗性進行驗證
(2)檢測出apoEVs中含有剪接體蛋白組分
(3)證明該蛋白的傳遞依賴于細胞的凋亡
(4)通過RNA-seq對受體細胞中RNA剪接情況進行檢測
(5)鎖定目標基因RBM11,并對該基因進行分子機制驗證
實驗結果:
1、apoEVs促進受體細胞向侵襲性表型轉化
研究者構建了小鼠的GBM臨床模型,并通過大量體內外生物學實驗證實,細胞凋亡導致GBM細胞分泌出數量更多且體積更大的細胞外囊泡(extracellular vesicles,EVs),存活細胞可以有效捕獲EV。存活細胞在EV中所包含的某種分泌因子的誘導下,向MES表型轉化,從而獲得更強的增殖能力、侵襲力和治療抗性。

Figure 1. 是否暴露于apoEVs中的小鼠生存曲線.

Figure 2. apoEVs促使PN GBM細胞向MES GBM細胞轉化
為了解析apoEVs的分子機制,研究者利用液相色譜-串聯質譜法(LC-MS),分別對未經處理的和受到致死輻射的腫瘤中EVs中的蛋白質種類進行了鑒定。結果顯示,在兩組樣本中存在顯著差異的主要有蛋白酶體和剪接體蛋白。剪接體蛋白通常與尿嘧啶富集的非編碼小RNA(U snRNAs)結合形成復合物,qRT-PCR顯示apoEVs中富含所有類型的剪接體U snRNAs復合物。


Figure 3. apoEVs中富含剪接體蛋白和U snRNAs
3、剪接體蛋白的傳遞依賴細胞凋亡蛋白酶
細胞凋亡蛋白酶的活化促使凋亡GBM細胞將剪接體蛋白從細胞核中釋放出來,然后由apoEVs封裝進入囊泡,繼而排出細胞,這可能是剪接體發生細胞間傳遞的可能機制之一。

Figure 4. 剪接體蛋白的傳遞依賴細胞凋亡蛋白酶
4、apoEVs誘導受體細胞中發生類似MES的剪接形式改變
發現apoEVs中的剪接體成分之后,研究者開始懷疑受體細胞中的表型改變是否是由RNA的可變剪接造成的?
為了驗證這一猜想,研究者分別對未經處理的MES GBM細胞和PN GBM細胞,加入apoEVs的PN GBM細胞和加入空白對照介質的PN GBM細胞,以及加入apoEVs后又將其過濾掉的PN GBM細胞,進行了雙端100bp的轉錄組測序(RNA-Seq)。測序結果顯示apoEVs對mRNA的剪切模式產生了重要影響。
對不同分組間的可變剪接事件(alternative splicing events,ASEs)進行維恩分析,超過30%的ASEs受到apoEVs的影響,而這些ASEs恰恰與MES GBM的治療抗性相關。GO分析顯示,apoEVs誘導的ASE會對調控DNA損傷修復和壓力回應的基因產生影響。

Figure 5. (A-B)apoEVs誘導的ASE會對調控DNA損傷修復和壓力回應的基因產生影響
為了檢測apoEVs對受體細胞基因表達的影響,研究者將加入apoEVs的GBM157細胞培養4天之后進行了RNA-Seq,結果顯示apoEVs的加入使得PN表型的marker基因表達下調,而MES表型的marker基因表達上調。

Figure 5. (D)apoEVs使得PN表型的marker基因表達下調,而MES表型的marker基因表達上調
內源性剪接抑制劑pladienolide B可抑制GBM細胞的生長,apoEVs則可以解除剪接抑制劑的抑制作用。

Figure 5. (E-F)apoEVs則可以解除剪接抑制劑的抑制作用
5、RBM11參與了apoEVs介導的受體細胞的表型改變
通過對一些目標基因的表達量比較,研究者鎖定了一個在MES GBM細胞中特異性存在的剪接因子RBM11作為核心基因,該基因在受體存活細胞中不存在,而在細胞發生凋亡時顯著上調,符合上文中研究者對分子機制的推測。
研究人員發現,外源性RBM11引起受體細胞內源性RBM11的上調和糖酵解的活化。RBM11的過度表達增加了膠質母細胞瘤細胞的遷移。他們還發現RBM11改變了RNA剪接,從而產生促進DNA修復的蛋白質cyclinD1的異構體和具有顯著更高的抗凋亡活性的蛋白質MDM4的異構體。這些變化可以使細胞更耐受治療。對癌癥基因組圖譜數據庫的檢查表明,這兩種異構體的表達升高與膠質母細胞瘤患者預后不良有關。
最后,該團隊研究了來自匹配患者的原發性和復發性腫瘤的成對膠質母細胞瘤標本。在43對匹配樣品中的大部分中,與原始未治療的腫瘤相比,復發性成膠質細胞瘤中的RBM11蛋白水平明顯更高。在另外兩個患者隊列中,他們發現RBM11水平越高,膠質瘤患者的術后生存率越差。

Figure 6. RBM11對RNA剪接的調控與細胞周期和細胞死亡有關
綜上,該研究揭示了基于apoEVs介導的剪接體蛋白轉移的癌細胞通訊機制。這種機制很可能適用于GBM以外的癌癥類型。 在臨床應用中,該研究數據可以為RNA剪接事件或特異性剪接因子的分子靶標提供論據,以減輕GBM治療后發生惡性轉化的可能。
------------------------------------------可變剪接算法---------------------------------------------------
可變剪接一直是疾病分子機制研究的熱點之一,Nakano團隊的研究則再次使其成為研究者們視線的焦點。數據分析起家的烈冰很早便開始關注可變剪接,早在2014年即自主研發了選擇性剪接分析軟件(ASD,Alternative Splicing Detector,網址:http://www.ayzzj.com/asd/ASD.html),相關文章發表于權威期刊Nucleic Acids Research(IF=10.162)[6]。

2017年4月6號,烈冰研發總監宗杰博士率生物信息研發團隊,在ASD的基礎上,開發出“進階級”可變剪接分析算法CASH(Comprehensive AS Hunting,網址:https://sourceforge.net/projects/cash-program/)以“CASH: a constructing comprehensive splice site method for detecting alternative splicing events”為題在線發表于生物信息類期刊Briefings in Bioinformatics(IF=5.134)。通過與Cuffdiff,MISO,DEXSeq和rMATS等已有算法進行比較后發現,無論在有生物學重復還是無生物學重復樣本中,CASH都顯著提升了樣本之間差異可變剪接事件的檢測能力,尤其是新的可變剪接事件,驗證準確率高達70%!在針對不同測序深度數據的測試中,CASH始終表現出優于其他算法的檢測率。即使是在低數據量下,CASH依舊力壓其他算法,始終維持著極高的敏感性及特異性。
這是繼ASD算法后,烈冰生物發表的第二篇可變剪接檢測算法類文章,創下業內同類算法的又一里程碑,在創新型企業自主研發算法攻堅之路上再下一城!


這兩種算法在發布后即被大量文獻引用,其中不乏Nature Communications、PloS Genetics 等高分期刊。此次ASD算法被Nakano團隊引用更是對我們莫大的支持和肯定,烈冰會繼續在自己擅長的生物信息分析領域深耕細作,推出更多更高質的產品和生信分析工具,憑借實力助力廣大科研工作者的科學研究。
想了解更多信息,請聯系您的區域業務經理進行咨詢~
參考文獻:
1. Phillips, H.S., Kharbanda, S., Chen, R., Forrest, W.F., Soriano, R.H., Wu, T.D., Misra, A., Nigro, J.M., Colman, H., Soroceanu, L., et al. (2006). Molecular subclasses of high-grade glioma predict prognosis, delineate a pattern of disease progression, and resemble stages in neurogenesis. Cancer Cell 9, 157–173.
2. Mao, P., Joshi, K., Li, J., Kim, S.H., Li, P., Santana-Santos, L., Luthra, S., Chandran, U.R., Benos, P.V., Smith, L., et al. (2013). Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3. Proc. Natl. Acad. Sci. USA 110, 8644–8649.
3. Verhaak, R.G., Hoadley, K.A., Purdom, E., Wang, V., Qi, Y., Wilkerson, M.D., Miller, C.R., Ding, L., Golub, T., Mesirov, J.P., et al. (2010). Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell 17, 98–110.
4. Bhat, K.P., Balasubramaniyan, V., Vaillant, B., Ezhilarasan, R., Hummelink, K., Hollingsworth, F., Wani, K., Heathcock, L., James, J.D., Goodman, L.D., et al. (2013). Mesenchymal differentiation mediated by NF-kB promotes radiation resistance in glioblastoma. Cancer Cell 24, 331–346.
5. Pavlyukov et al., Apoptotic Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors, Cancer Cell (2018), https://doi.org/10.1016/j.ccell.2018.05.012.
6、Zhou X, et al. Transcriptome analysis of alternative splicing events regulated by SRSF10 reveals position-dependent splicing modulation. Nucleic Acids Res. 2014 Apr;42(6):4019-30.